Cambiando las bases del juego: modificaciones de ARN y su papel en trastornos cerebrales
 |
Las modificaciones del ARN se pueden producir tanto en ARN codificante (se traduce en proteína) o en ARN no codificante. Vamos a describir las modificaciones de ARN más importantes y sus consecuencias a nivel celular:
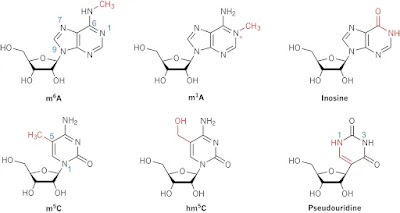
N-6-metiladenosina (m6A): 0,2% de los transcritos de ARN, principalmente en las proximidades de los codones de terminación y dentro de los exones largos, relacionado con su función de regular la vida media del ARNm.
Además, la m6A altera el plegamiento y la estructura del ARN, y participa en la maduración del ARN mediante capping-5’, la poliadenilación y el splicing. Además facilita la localización celular apropiada y la exportación nuclear del ARNm.
1-Metiladenosina (m1A): Es común en el ARNr y el ARNt, donde mantiene la estructura terciaria y afecta la traducción. La m1A se encuentra en todas las regiones de los transcritos (codificantes o no traducidas). También se ha encontrado que las moléculas de ARNm contienen m1A, aunque su función es menos conocida. La m1A puede aumentar la traducción del ARNm al disminuir la unión del factor liberador, o disminuir la traducción al interrumpir el plegamiento del ARN alrededor del sitio de iniciación de la traducción.
5-Metilcitosina (m5C): Se encuentra normalmente en el ADN pero también puede encontrarse en el ARN, principalmente en las regiones no traducidas (UTRs) del ARNm y cerca de los sitios de unión para la proteína Argonauta (parte de la maquinaria de degradación del ARN). La modificación m5C es dinámica, no se elimina, sino que se oxida a 5-hidroximetilcitosina (hm5C). hm5C tiende a encontrarse en polirribosomas y está asociada con un aumento en la eficiencia de la traducción (Drosophila).
Pseudouridina (Ψ): Ψ es un isómero de la uridina que no afecta el apareamiento de bases canónico y es especialmente abundante en el ARNt y el ARNr, pero también se encuentra en el ARN pequeño nuclear (snARN). La formación de Ψ se inicia por señales ambientales y se considera una modificación irreversible del ARN, implicado en la estabilización del ARNm, la localización intracelular de los transcritos y la terminación de la traducción.
Queuosina (Q) es un nucleósido que se agrega enzimáticamente a ARNt específicos. En eucariotas, la producción de queuosina comienza con el consumo en la dieta o la producción microbiana de la base queuina que luego se modifica y se agrega al ARN de manera postranscripcional por la tARN-guanina transglicosilasa (TGTasa).
La interrupción genética de la TGTasa afecta la capacidad de producir tirosina a partir de fenilalanina, con el potencial de influir en la producción de neurotransmisores monoaminérgicos como la dopamina.
 |
| Harcourt, E. M., Kietrys, A. M., & Kool, E. T. (2017). Chemical and structural effects of base modifications in messenger RNA. Nature, 541(7637), 339–346. doi:10.1038/nature21351 |
Estas
modificaciones tienen un impacto directo en muchas enfermedades. Vamos a
describir trastornos cerebrales relacionados con la modificación del ARN:
La
inactivación genética de la metiltransferasa 1 del ARNt , que cataliza la
dimetilación de guanosinas en ARNts, causa trastornos cognitivos. Además,
mutaciones parcialmente inactivas en la pseudouridilasa 3 (Pus3), que cataliza
la isomerización de uracilo a Ψ en ciertos ARNt; están asociadas con
discapacidad intelectual.
Otro ejemplo son
los defectos genéticos en las enzimas m5C, que están estrechamente asociados
con trastornos neurológicos. Las mutaciones en las metiltransferasas de ARN
m5C, Nsun2 y Dnmt2, que metilan varios ARNt diferentes; están asociadas con
trastornos del sistema nervioso. Las variantes genéticas de NSUN2 también se
han relacionado con discapacidad intelectual.
BIBLIOGRAFÍA
Comentarios
Publicar un comentario